FIZYKA - Budowa i właściwości Atomu
 Atom (z gr.atomos : "niepodzielny") – najmniejszy, niepodzielny metodami chemicznymi składnik materii.
Atomy składają się z jądra i otaczających to jądro elektronów. W jądrze znajdują się z kolei protony i neutrony. Jądro jest kilkadziesiąt tysięcy razy mniejsze od całego atomu i skupia ono w sobie praktycznie całą masę atomu, gdyż proton i neutron są o ok. 2000 razy cięższe od elektronu. Protony i neutrony mają w przybliżeniu taką samą masę. Neutrony są cząstkami obojętnymi elektrycznie, protony noszą ładunek elektryczny dodatni, zaś elektrony ujemny. W każdym atomie w stanie podstawowym liczba protonów i elektronów jest jednakowa. Wartość ładunku elektrycznego protonów i elektronów jest także jednakowa, więc atomy jako całość są obojętne elektrycznie. Atomy z liczbą elektronów różną od liczby protonów nazywane są jonami.
O właściwościach atomów decyduje głównie liczba protonów w jądrze atomowym, atomy o takiej samej liczbie protonów w jądrze należą do tego samego pierwiastka chemicznego.
Atomy są podstawowymi elementami budującymi materię w chemii, nie zmieniają się w reakcjach chemicznych. Atomy są najmniejszymi cząstkami rozróżnianymi metodami chemicznymi.
Atom (z gr.atomos : "niepodzielny") – najmniejszy, niepodzielny metodami chemicznymi składnik materii.
Atomy składają się z jądra i otaczających to jądro elektronów. W jądrze znajdują się z kolei protony i neutrony. Jądro jest kilkadziesiąt tysięcy razy mniejsze od całego atomu i skupia ono w sobie praktycznie całą masę atomu, gdyż proton i neutron są o ok. 2000 razy cięższe od elektronu. Protony i neutrony mają w przybliżeniu taką samą masę. Neutrony są cząstkami obojętnymi elektrycznie, protony noszą ładunek elektryczny dodatni, zaś elektrony ujemny. W każdym atomie w stanie podstawowym liczba protonów i elektronów jest jednakowa. Wartość ładunku elektrycznego protonów i elektronów jest także jednakowa, więc atomy jako całość są obojętne elektrycznie. Atomy z liczbą elektronów różną od liczby protonów nazywane są jonami.
O właściwościach atomów decyduje głównie liczba protonów w jądrze atomowym, atomy o takiej samej liczbie protonów w jądrze należą do tego samego pierwiastka chemicznego.
Atomy są podstawowymi elementami budującymi materię w chemii, nie zmieniają się w reakcjach chemicznych. Atomy są najmniejszymi cząstkami rozróżnianymi metodami chemicznymi.  elektron - e - -1,6*10-19C = 0,00055u
elektron - e - -1,6*10-19C = 0,00055u proton - p - 1,6*10-19C = 1,0073u
proton - p - 1,6*10-19C = 1,0073u neutron - n - 0 = 1,0086u
neutron - n - 0 = 1,0086u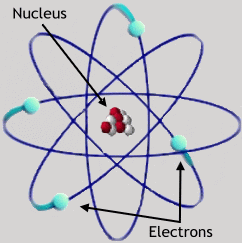
 Atomy różnych pierwiastków różnią się liczbą atomową, (Z), która wskazuje na liczbę protonów bądź elektronów.
Atomy różnych pierwiastków różnią się liczbą atomową, (Z), która wskazuje na liczbę protonów bądź elektronów. Ten sam pierwiastek może posiadać różną liczbę neutronów w jądrze atomowym i mówimy wtedy o jego izotopach. np. Wodór posiada 3 izotopy: prot, deuter i tryt, które maja odpowiednio 0, 1, 2 neutrony.
Ten sam pierwiastek może posiadać różną liczbę neutronów w jądrze atomowym i mówimy wtedy o jego izotopach. np. Wodór posiada 3 izotopy: prot, deuter i tryt, które maja odpowiednio 0, 1, 2 neutrony. Ilość neutronów wskazuje liczba masowa (A) stanowiąca właśnie sumę protonów i neutronów.
Ilość neutronów wskazuje liczba masowa (A) stanowiąca właśnie sumę protonów i neutronów. Odmiany pierwiastka o identycznej liczbie masowej i atomowej noszą nazwę nuklidów.
Odmiany pierwiastka o identycznej liczbie masowej i atomowej noszą nazwę nuklidów. Elektrony rozmieszczone są na powłokach, które z kolei składają się z podpowłok.
Elektrony rozmieszczone są na powłokach, które z kolei składają się z podpowłok. 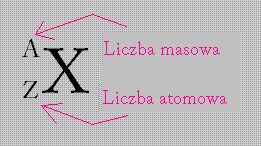
 Poniższy wzór pozwala obliczyć maksymalną ilość elektronów na określonej powłoce:
Poniższy wzór pozwala obliczyć maksymalną ilość elektronów na określonej powłoce:2n2, gdzie:
n - numer powłoki
Powłoki oznacza się kolejno literami: K L M N O P Q
Podpowłoki oznacza się kolejno: s p d f
 Izotopy - odmiany pierwiastków chemicznych, różniące się liczbą neutronów w jądrach, a tym samym i liczbą masową. Atomy danego pierwiastka (o określonej liczbie protonów) będące różnymi izotopami różnią się liczbą masową (liczba neutronów i protonów w jądrze), różne izotopy mają niemal identyczne własności chemiczne.
Izotopy - odmiany pierwiastków chemicznych, różniące się liczbą neutronów w jądrach, a tym samym i liczbą masową. Atomy danego pierwiastka (o określonej liczbie protonów) będące różnymi izotopami różnią się liczbą masową (liczba neutronów i protonów w jądrze), różne izotopy mają niemal identyczne własności chemiczne.1 H i 2H i 3H - odpowiednio - Prot , Deuter i Tryt.
 Izobary – jądra atomowe o równej liczbie masowej A, różniące się liczbą atomową Z. W praktyce oznacza to, że izobarami są atomy różnych pierwiastków, mające jednak tę samą liczbę nukleonów.Jak dotąd nie znaleziono, dwóch trwałych izobarów o liczbach atomowych różniących się o 1 (sąsiadujące w układzie okresowym pierwiastków).
Izobary – jądra atomowe o równej liczbie masowej A, różniące się liczbą atomową Z. W praktyce oznacza to, że izobarami są atomy różnych pierwiastków, mające jednak tę samą liczbę nukleonów.Jak dotąd nie znaleziono, dwóch trwałych izobarów o liczbach atomowych różniących się o 1 (sąsiadujące w układzie okresowym pierwiastków).17N, 17O i 17F
 Izotony – nuklidy pierwiastków, mające tę samą liczbę neutronów (n0) w jądrze atomowym.
Izotony – nuklidy pierwiastków, mające tę samą liczbę neutronów (n0) w jądrze atomowym.2H i 3He
 Wzór na masę atomu:
Wzór na masę atomu: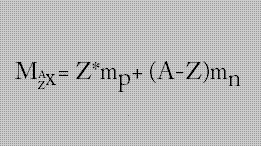
Bibliografia:
- www.wikipedia.org
- „Encyklopedia fizyki” – Państwowe Wydawnictwo Naukowe, Warszawa 1974
- http://images.google.pl/
- Podręcznik od Fizyki - zeszyt